راهنمای جامع GAMP5 برای معتبرسازی سیستمهای کامپیوتری در صنعت دارو
- Morteza Aghajani
- دستهبندی نشده
راهنمای جامع GAMP5 برای معتبرسازی سیستمهای کامپیوتری در صنعت دارو یکی از منابع کلیدی برای پیادهسازی الزامات کیفیت و انطباق در سیستمهای نرمافزاری است که در محیطهای تنظیمگریافته مانند صنایع دارویی مورد استفاده قرار میگیرند. استاندارد GAMP5 با ارائه رویکردی مبتنی بر تحلیل ریسک، به شرکتهای دارویی کمک میکند تا فرآیند معتبرسازی سیستمهای کامپیوتری را به شکلی ساختاریافته، مستند و قابل دفاع پیادهسازی کنند. در این مقاله بهطور کامل به اصول GAMP5، مراحل پیادهسازی، دستهبندی نرمافزارها، و نقش مستندسازی در تضمین انطباق با الزامات سازمانهایی مانند FDA و EMA پرداخته میشود.
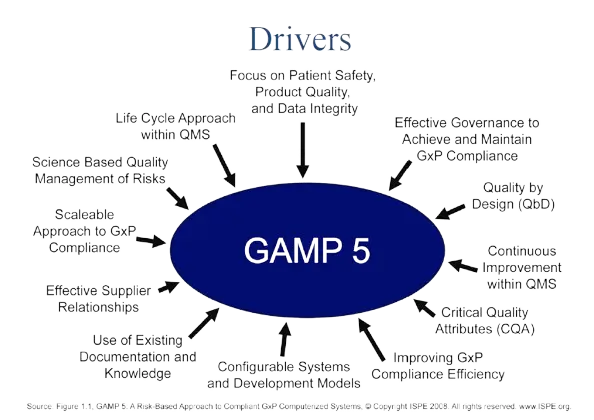
GAMP5 چیست و چرا در CSV اهمیت دارد؟
معرفی GAMP5
GAMP5 یا Good Automated Manufacturing Practice نسخه ۵، راهنمایی است که توسط انجمن بینالمللی ISPE توسعه یافته و برای معتبرسازی سیستمهای کامپیوتری در صنایع تحت نظارت مانند داروسازی و زیستفناوری کاربرد دارد.
دلایل اهمیت GAMP5 در صنعت دارو
تضمین کیفیت و انطباق با مقررات
کاهش ریسکهای سیستمهای کامپیوتری
مستندسازی اثربخش و قابلاتکا
سادهسازی فرآیند CSV با رویکرد ریسکمحور
اصول کلیدی GAMP5 در معتبرسازی سیستمهای کامپیوتری
رویکرد مبتنی بر ریسک
یکی از اصول محوری GAMP5، تمرکز بر مدیریت ریسک سیستمهای کامپیوتری است. این رویکرد باعث میشود منابع بر روی بخشهایی از سیستم که بیشترین تأثیر را بر کیفیت محصول و ایمنی بیمار دارند متمرکز شوند.
طبقهبندی نرمافزارها (Software Categories)
GAMP5 سیستمهای نرمافزاری را به ۵ دسته تقسیم میکند. شناخت این دستهبندیها برای انتخاب روش مناسب CSV ضروری است:
Category 1: نرمافزارهای پایهای (مثلاً سیستمعامل)
Category 3: نرمافزارهای استاندارد پیکربندینشده
Category 4: نرمافزارهای استاندارد قابل پیکربندی
Category 5: نرمافزارهای سفارشی (Custom-built)
چرخه عمر سیستم در چارچوب GAMP5
چرخه عمر سیستم در GAMP5 شامل مراحل زیر است:
۱. آغاز پروژه (Concept)
تعریف نیازمندیهای کسبوکار
تعیین محدوده سیستم
۲. طراحی و توسعه
تعریف نیازمندیهای کاربر (URS)
طراحی عملکردی (FRS) و طراحی فنی (DS)
انتخاب تأمینکننده مناسب
۳. تست و تأیید (Verification)
تست واحد (Unit Test)
تستهای یکپارچگی (IQ)، عملیاتی (OQ) و عملکردی (PQ)
تهیه و تأیید مستندات تست
۴. بهرهبرداری و نگهداری
کنترل تغییرات (Change Control)
مدیریت رویدادها و اشکالات
بازبینی دورهای
۵. از کاراندازی سیستم
مستندسازی نهایی
آرشیو دادهها و اطلاعات مهم
مستندات کلیدی در GAMP5 برای CSV
User Requirements Specification (URS)
بیان دقیق نیازمندیهایی که سیستم باید برآورده کند.
Risk Assessment
تحلیل و ارزیابی ریسکهای بالقوه مرتبط با عملکرد سیستم.
Validation Plan (VMP)
طرح کلی فعالیتهای معتبرسازی، مسئولیتها و منابع.
Test Protocols (IQ/OQ/PQ)
پروتکلهای تست برای تأیید نصب، عملکرد و قابلیت اطمینان سیستم.
Validation Report
جمعبندی نهایی فعالیتهای معتبرسازی و نتیجهگیری.
مقایسه GAMP5 با استانداردهای دیگر CSV
در مقایسه با سایر استانداردهای معتبرسازی سیستمهای کامپیوتری، GAMP5 بهعنوان یک چارچوب اجرایی جامع و منعطف شناخته میشود. Annex 11 از الزامات EU-GMP است که تمرکز ویژهای بر سیستمهای الکترونیکی و جنبههای فنی آنها دارد و در عمل، GAMP5 بهعنوان ابزاری اجرایی برای پیادهسازی این ضمیمه بهکار میرود.
در سوی دیگر، 21 CFR Part 11 که توسط FDA ارائه شده، بر امنیت دادههای الکترونیکی و امضای دیجیتال تأکید دارد و GAMP5 چارچوب مناسبی برای انطباق با این قانون به شمار میآید. همچنین، CSA (Computer Software Assurance) بهعنوان رویکرد نوین FDA جایگزین مدل سنتی CSV در حال معرفی است که بر ارزیابی مبتنی بر ریسک با تأکید بر عملکرد سیستم تمرکز دارد و GAMP5 با انعطافپذیری خود، قابلیت هماهنگی با این رویکرد جدید را نیز داراست.
مزایای پیادهسازی GAMP5 در صنعت داروسازی
افزایش کیفیت سیستمها و محصولات
کاهش هزینههای دوبارهکاری و بازرسی
بهبود آمادگی در ممیزیها و بازرسیهای FDA و EMA
سازگاری با رویکردهای مدرن از جمله CSA
چالشها و راهکارهای اجرایی GAMP5
چالشها
پیچیدگی مستندسازی
مقاومت تیمها در برابر تغییر
کمبود نیروی متخصص داخلی
راهکارها
آموزش کارکنان
استفاده از مشاوران خبره
طراحی سیستم سادهسازیشده و مؤثر
توصیه برای موفقیت در CSV با GAMP5
برای موفقیت در معتبرسازی سیستمهای کامپیوتری، استفاده از چارچوب GAMP5 نهتنها توصیه میشود، بلکه امروزه به یک الزام در صنایع دارویی تبدیل شده است. با درک صحیح اصول، مراحل و اسناد GAMP5 میتوان فرآیند CSV را کارآمد، کمهزینه و مطابق با مقررات انجام داد.
پرسشهای متداول درباره GAMP5 در CSV
۱. آیا GAMP5 یک استاندارد الزامی است؟
خیر، اما توسط نهادهای نظارتی مانند FDA و EMA بهعنوان یک رویه برتر (Best Practice) برای معتبرسازی سیستمهای کامپیوتری پذیرفته شده است.
۲. آیا GAMP5 برای شرکتهای کوچک هم مناسب است؟
بله، GAMP5 با طراحی مقیاسپذیر و رویکرد ریسکمحور، برای شرکتهای کوچک و متوسط نیز قابل استفاده و بهینهسازی است.
۳. چه تفاوتی میان GAMP4 و GAMP5 وجود دارد؟
GAMP5 تأکید بیشتری بر مدیریت ریسک، تحلیل اثرات سیستمی، و نقش کاربران دارد و نسخهای بهروزتر و انعطافپذیرتر نسبت به GAMP4 است.
۴. آیا GAMP5 فقط برای سیستمهای نرمافزاری کاربرد دارد؟
خیر، GAMP5 هم برای سیستمهای سختافزاری، هم نرمافزاری و هم سیستمهای ترکیبی در فرآیندهای خودکار کاربرد دارد.
۵. آیا GAMP5 با الزامات CFR Part 11 و Annex 11 سازگار است؟
بله، GAMP5 بهگونهای طراحی شده که پیادهسازی آن میتواند الزامات CFR Part 11 (FDA) و Annex 11 (EU-GMP) را بهطور کامل پوشش دهد.
۶. GAMP5 چه کمکی به ممیزیها و بازرسیهای دارویی میکند؟
با ارائه مستندسازی ساختارمند، فرآیندهای قابل پیگیری و ارزیابی ریسک، اجرای GAMP5 آمادگی شرکتها برای ممیزیهای بینالمللی را بهطور چشمگیری افزایش میدهد.
۷. آیا اجرای GAMP5 نیاز به تیم تخصصی دارد؟
ترجیحاً بله؛ برای اجرای دقیق GAMP5 نیاز به همکاری میان تیمهای مهندسی، کیفیت، IT و مشاوران CSV وجود دارد تا خروجی مطمئن حاصل شود.
۸. اجرای GAMP5 چقدر زمانبر است؟
بسته به پیچیدگی سیستم، اجرای GAMP5 ممکن است از چند هفته تا چند ماه طول بکشد؛ اما با برنامهریزی درست و تخصیص منابع، این فرآیند قابل مدیریت است.
۹. آیا میتوان از چارچوب GAMP5 برای سیستمهای SaaS نیز استفاده کرد؟
بله، با تطبیق اصول GAMP5 و ارزیابی ریسکها، حتی سیستمهای مبتنی بر فضای ابری و SaaS نیز میتوانند تحت این چارچوب معتبرسازی شوند.
۱۰. چه منابعی برای یادگیری بیشتر GAMP5 پیشنهاد میشود؟
منابعی همچون راهنمای رسمی GAMP5 از ISPE، دورههای آموزشی CSV، مقالات تخصصی و مستندات سازمانهای نظارتی مانند FDA و EMA برای یادگیری دقیق GAMP5 توصیه میشود.

